К признакам клинической смерти у ребенка относят полное отсутствие сознания, дыхания и сердечных сокращений. Исчезают все рефлексы (в том числе и роговичный). Зрачки ребенка расширены и на свет не реагируют. Кожа и слизистые оболочки, бледные или бледноцианотичные, развивается мышечная атония. Из этой статьи вы узнаете не только признаки данного состояния, но и о том, как оказать помощь при клинической смерти.

Основные признаки клинической и биологической смерти
Остановку сердца диагностируют при отсутствии сердечных сокращений и пульса на сонных артериях в течение 5 с.
Остановку дыхания диагностируют при отсутствии дыхательных движений у ребёнка в течение 10-15 секунд, а у недоношенных детей - более 20 с.
Внезапно наступившую смерть расценивают как клиническую в течение 5 минут с момента её наступления. Если клинической смерти предшествовало тяжёлое заболевание ребенка, протекавшее с нарушениями микроциркуляции, кровообращения, гипоксией, то длительность периода, расцениваемого как клиническая смерть, может сокращаться до 1-2 мин. При генерализованном охлаждении организма устойчивость клеток коры головного мозга к гипоксии увеличивается.
Признаки биологической смерти
После того как были диагностированы признаки клинической смерти наступает смерть мозга и биологическая смерть.
Смерть мозга характеризуется полным необратимым повреждением коры головного мозга.
К ранним симптомам биологической смерти, свидетельствующим о необратимости состояния, относят помутнение зрачка (симптом "тающей льдинки") и стойко сохраняющиеся изменения формы зрачка при сдавливании глазного яблока (симптом "кошачьего глаза"), бледность и похолодание кожи. Наиболее достоверные признаки биологической смерти - трупные пятна и трупное окоченение. Они появляются значительно позже.
Терминальное состояние - главный признак клинической смерти
Терминальные состояния характеризуются развитием неврологических нарушений и прогрессирующей декомпенсацией дыхания и кровообращения.
К терминальным относят преагональное, атональное состояния и клиническую смерть. Продолжительность и клиническая картина преагонального и агонального состояний зависят от характера и длительности заболевания, приведшего к их развитию. Эта зависимость полностью исчезает при клинической смерти.
Клиническая смерть детей - короткий (4-6 мин) промежуток времени, наступающий после прекращения сердечной деятельности и дыхания и продолжающийся до наступления необратимых изменений в высших отделах ЦНС, когда ещё возможно восстановление всех функций организма. После клинической смерти наступает мозговая смерть, а затем - биологическая. Последняя характеризуется полной утратой всех функций организма.
По данным статистики, своевременное и квалифицированное проведение первичной сердечно-лёгочной реанимации позволяет избежать летальных исходов в 30-50% случаев, когда уже произведено определение признаков клинической смерти.
Симптомы клинической смерти
Признаками клинической смерти являются остановка сердца с прекращением его насосной функции и/или остановка дыхания (первичная или вторичная после прекращения работы сердца). Остановка сердца и дыхания может быть результатом многочисленных патологических состояний или несчастных случаев.
Причины остановки сердца многообразны: она может быть следствием тяжёлых заболеваний, но может возникнуть внезапно у практически здоровых людей (например, внезапная сердечная смерть, рефлекторная остановка сердца при проведении диагностических и лечебных процедур, стрессовых ситуациях, психических травмах).
Остановка кровообращения - остановка сердца может развиться вследствие массивной кровопотери, при тяжёлых механических и электрических травмах, в результате отравлений, аллергических реакций, при ожогах, аспирации инородных тел и т.д.
Асистолия - полное прекращение деятельности всех отделов сердца или одного из них с отсутствием признаков биоэлектрической активности. Этот признак клинической смерти возникает при тяжёлой прогрессирующей гипоксии на фоне ваготонии. Асистолия может развиться у детей с эндокринными заболеваниями, выраженной анемией, при тяжёлых интоксикациях.
Фибрилляция или трепетание желудочков сердца - аритмия сердца, характеризующаяся полной асинхронностью сокращения миофибрилл желудочков, что ведёт к прекращению насосной функции сердца. Фибрилляция развивается при асфиксии различного происхождения (утопление, электротравма, передозировка сердечных гликозидов) на фоне пароксизмальной тахикардии и групповых экстрасистол. Также гемодинамически неэффективными являются желудочковые тахикардии.
Электромеханическая диссоциация - отсутствие сократительной деятельности миокарда при наличии обычной электрической импульсации в проводящей системе сердца. Признаки состояния клинической смерти могут возникать при разрыве и острой тампонаде сердца, выраженной гипоксии и хронической сердечной недостаточности.
Помимо нарушения деятельности самого сердца к терминальному состоянию может привести и сосудистый коллапс, обусловленный самыми различными причинами (шоки различного генеза).
Остановка дыхания - первый признак клинической смерти
Основные причины первичной остановки дыхания следующие:
- Непроходимость дыхательных путей вследствие аспирации инородного тела, спазма и отёка голосовой щели, воспалительных, травматических и других поражений глотки и гортани, а также бронхоспазма и обширного поражения паренхимы лёгких (пневмония, отёк лёгких, лёгочное кровотечение).
- Поражение дыхательного центра со снижением активности при отравлениях, передозировке ЛС, заболеваниях головного мозга.
- Расстройство вентиляции лёгких при пневмотораксе, травматических повреждениях грудной клетки, нарушениях иннервации дыхательной мускулатуры.
Наиболее частые причины остановки дыхания и кровообращения у детей
Несмотря на большое количество причин, приводящих к необходимости сердечно-лёгочной реанимации, у детей выделяют относительно небольшой спектр факторов и состояний, наиболее часто обусловливающих клиническую смерть:
- несчастные случаи на транспорте,
- утопления,
- ожоги,
- инфекции (дыхательных путей и системные),
- вдыхание дыма,
- обструкция дыхательных путей инородными телами и удушье,
- отравления,
- ВПС.
Независимо от причины терминального состояния, его патогенетическое развитие всегда связано с гипоксией с последующим нарушением деятельности митохондрий, вследствие чего возникает гибель самих клеток.
Организм реагирует на гипоксию защитой ЦНС за счёт централизации кровообращения и периферического вазоспазма (повышение активности сосудодвигательного центра). Одновременно у ребёнка возникают стимуляция дыхательного центра, двигательное и психическое беспокойство.
При прогрессировании гипоксии и декомпенсации периферического кровотока для обеспечения на некоторое время хотя бы минимального поступления энергии включаются анаэробные пути окисления глюкозы, что сопровождается развитием молочнокислого ацидоза с дальнейшим нарушением микроциркуляции и снижением содержания глюкозы и макроэргических соединений в тканях. Дефицит энергии приводит к декомпенсации мембранного транспорта, разрушению мембран, внутриклеточному отёку, гибели митохондрий клеток. Возникают набухание головного мозга и повреждение миокарда.
Наиболее чувствительны к гипоксии нейроны головного мозга (особенно коры) вследствие высокой активности проходящих в них метаболических процессов. При необратимом повреждении большинства нейронов развивается биологическая смерть.
Клиническую картину терминальных состояний определяют нарастающей декомпенсацией функций жизненно важных систем (нервной, дыхательной и сердечно-сосудистой).
Агональное состояние - признак внезапной клинической смерти
При агональном состоянии клинической смерти сознание утрачено (глубокая кома). Пульс и АД определить невозможно. При аускультации отмечают глухие тоны сердца. Дыхание поверхностное (малый дыхательный объём), агональное ("гаспинг" - дыхание, характеризующееся редкими, короткими и глубокими судорожными дыхательными движениями), обычно заканчивается генерализованным вдохом с участием всей вспомогательной мускулатуры и остановкой дыхания.
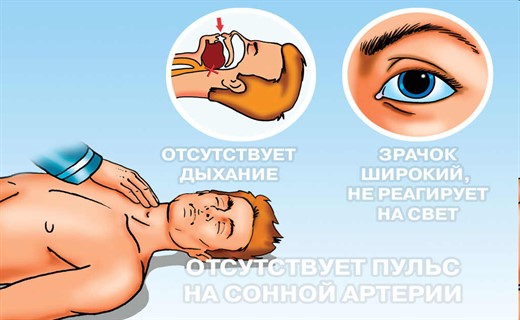
Определение клинической смерти
Клиническая смерть детей диагностируется на основании определенных признаков:
- отсутствие кровообращения;
- отсутствие самостоятельного дыхания;
- расширение зрачков и отсутствие их реакции на свет;
- отсутствие сознания и полная арефлексия.
Отсутствия пульса на сонных артериях при пальпации - самый простой и быстрый способ диагностики остановки кровообращения. С этой же целью можно использовать и другой прием: аускультацию сердца (фонендоскопом или непосредственно ухом) в области проекции его верхушки. Отсутствие сердечных тонов будет свидетельствовать об остановке сердца.
Остановку дыхания можно определить по отсутствию колебаний ниточки или волоса, поднесенных к области рта или носа. На основании наблюдения за движениями грудной клетки трудно установить остановку дыхания, особенно у детей раннего возраста.
Расширение зрачков и отсутствие реакции на свет являются признаками гипоксии мозга и проявляются через 40-60 секунд посте остановки кровообращения.
Как констатируется клиническая смерть детей?
Для этого еще до начала реанимации, необходимо выполнить два обязательных действия:
Отметить время остановки сердца (или начала реанимационных мероприятий).
Позвать на помощь. Хорошо известен тот факт, что один человек, как бы он ни был обучен, не сможет достаточно долю проводить эффективные реанимационные мероприятия даже в минимальном объеме.
Первая помощь при клинической смерти
Учитывая чрезвычайно короткий срок, в течение которого можно надеяться на успех при лечении детей, находящихся в состоянии клинической смерти, все реанимационные мероприятия должны начинаться как можно быстрее и выполняться четко и грамотно. Для этого реанимирующий обязан знать, как должна оказываться помощь при клинической смерти, строгий алгоритм действий в данной ситуации. Основой подобного алгоритма стала "Азбука реанимационных мероприятий" Питера Сафара, в которой этапы процесса оживления описаны в строгом порядке и "привязаны" к буквам английского алфавита.
Первичная сердечно-легочная реанимация
С чего начинается помощь при клинической смерти? Первый этап реанимационных мероприятий называется первичной сердечно-легочной реанимацией и состоит из трех пунктов:
- Airway (дыхательные пути)
- Breathing (дыхание)
- Circulation (кровообращение)
Свободная проходимость дыхательных путей обеспечивается в зависимости от обстоятельств различными способами. В тех случаях, когда можно подозревать, что в дыхательных путях нет большою количества содержимого, проводят следующие мероприятия: ребенка укладывают на бок (или просто поворачивают на бок голову), раскрывают ему рот и очищают ротовую полость и глотку тупфером или пальцем, обернутым материей.
Агоритм неотложной помощи при клинической смерти
При наличии большого количества жидкого содержимого в дыхательных путях (например, при утоплении) маленького ребенка приподнимают за ноги вниз толовой, слегка запрокидывают голову, постукивают по спине вдоль позвоночника, а затем осуществляют уже описанную выше пальцевую санацию. В этой же ситуации старших детей можно положить животом на бедро реаниматора так, чтобы голова свободно свисала вниз.
При удалении твердого тела лучше всего провести прием Геймлиха: плотно обхватить туловище пациента обеими руками (или пальцами, если это маленький ребенок под реберной дугой и осуществить резкое сдавление нижнего отдела грудной клетки в сочетании с толчком диафрагмы в краниальном направлении через подложечную область. Прием рассчитан на мгновенное повышение внутрилегочного давления, которым инородное тело может быть вытолкнуто из дыхательных путей. Резкое нажатие на эпигастральную область приводит к повышению давления в трахеобронхиальном дереве как минимум в два раза большему, чем постукивание по спине.
При отсутствии эффекта и невозможности выполнить прямую ларингоскопию, при клинической смерти возможно проведение микрокониостомии - перфорации перстневидно-щитовидной мембраны толстой иглой. Перстневидно-щитовидная мембрана располагается между нижним краем щитовидного и верхним краем перстневидного хрящей гортани. Между ней и кожей имеется незначительная прослойка мышечных волокон, отсутствуют крупные сосуды и нервы. Найти мембрану относительно легко. Если ориентироваться от верхней вырезки щитовидного хряща, то спускаясь по средней линии, обнаруживаем небольшую впадину между передней дугой перстневидного хряща и нижним краем щитовидного - это и есть перстневидно-щитовидная мембрана. Голосовые связки расположены чуть краниальнее мембраны, поэтому при манипуляции они не повреждаются. Для выполнения микрокониостомии требуется несколько секунд.
Техника проведения микрокониостомии следующая:
- голова максимально запрокинута назад (желательно подложить под плечи валик);
- большим и средним пальцем фиксируется гортань за боковые поверхности щитовидного хряща;
- указательным пальцем определяется мембрана. Игла предварительно согнутая под тупым углом, вводится в мембрану строго по срединной линии до ощущения "провала", которое указывает на то, что конец иглы находится в полости гортани.
Порядок оказания первой помощи при клинической смерти
Необходимо отметить, что даже в догоспитальных условиях, если у больною имеет место полная обструкция в области гортани, возможно проведение экстренного вскрытия перстневидно-щитовидной мембраны, которое называется кониотомией. Для осуществления данной операции требуется та же укладка больного, как и для микрокониостомии. Точно так же фиксируется гортань и определяется мембрана. Затем непосредственно над мембраной делается поперечный разрез кожи длиной около 1,5 см. В кожный разрез вводится указательный палец так, чтобы верхушка ногтевой фаланги и упиралась в мембрану. Но ногтю, касаясь его плоскостью ножа, перфорируется мембрана и через отверстие вводится полая трубка. Манипуляция занимает от 15 до 30 секунд (что выгодно отличает кониостомию от трахеостомии, для выполнения которой требуется несколько минут). Нельзя не отметить, что в настоящее время выпускаются специальные кониотомические наборы, которые состоят из бритвы-жала для рассечения кожи, троакара для проведения в гортань специальной канюли и самой канюли, надетой на троакар.
В госпитальных условиях для удаления содержимого дыхательных путей пользуются механическими отсосами. После очищения ротовой полости и глотки от содержимого на доврачебном этапе необходимо придать ребенку положение, обеспечивающее максимальную проходимость дыхательных путей. Для этого выполняется разгибание головы, выведение вперед нижней челюсти и открывание рта.
Разгибание головы позволяет поддерживать проходимость дыхательных путей у 80% больных, находящихся без сознания, так как в результате данной манипуляции происходит натяжение тканей между гортанью и нижней челюстью. При этом корень языка отходит от задней стенки глотки. Для того, чтобы обеспечить запрокидывание головы достаточно подложить под верхний плечевой пояс валик.
При выведение нижней челюсти необходимо, чтобы нижний ряд зубов оказался впереди верхнего. Рот открывают небольшим по силе, противоположно направленным движением больших пальцев. Положение головы и челюсти необходимо поддерживать в течение всех реанимационных мероприятий до введения воздуховода или интубации трахеи.
На догоспитальном этапе для поддержания корня языка можно использовать воздуховоды. Введение воздуховода в подавляющем большинстве случаев (при нормальной анатомии глотки) освобождает от необходимости постоянно удерживать в выведенном положении нижнюю челюсть, что значительно облетает проведение реанимационных мероприятий. Введение воздуховода, представляющего собой дугообразную трубку овального сечения с загубником, осуществляется следующим образом: вначале воздуховод вставляют в рот пациента изгибом вниз, продвигают до корня языка и лишь затем устанавливают в нужную позицию путем поворота его на 180 градусов.
Точно с такой же целью применяют S-образную трубку (трубку Сафара), которая напоминает собой два воздуховода, соединенные вместе. Дистальный конец трубки используется для вдувания воздуха при проведении искусственной вентиляции легких.
При проведении сердечно-легочной реанимации медицинским работником интубация трахеи должна быть плавным методом обеспечения свободной проходимости дыхательных путей. Интубация трахеи может быть как оротрахеальной (через рот), так и назотрахеальной (через нос). Выбор одной из этих двух методик определяется тем, как долго предполагается стояние интубационной трубки в трахее, а также наличием повреждений или заболеваний соответствующих отделов лицевого черепа, рта и носа.
Техника оротрахеальной интубации при клинической смерти, заключается в следующем: интубационная трубка вводится всегда (за редким исключением) под прямым ларингоскопическим контролем. Больного укладывают в горизонтальное положение на спине, с максимально запрокину головой и приподнятым подбородком. Чтобы исключить возможность регургитации желудочного содержимого в момент интубации трахеи, рекомендуется использовать прием Селлика: помощник прижимает гортань к позвоночнику, и между ними сдавливается фарингеальный конец пищевода.
Клинок ларингоскопа вводят в рот, отодвигая язык вверх, чтобы увидеть первый ориентир - язычок мягкого неба. Продвигая клинок ларингоскопа глубже, ищут второй ориентир - надгортанник. Приподняв его кверху, обнажают голосовую щель, в которую движением от правого угла рта - чтобы не закрывать поле зрения - вводят интубационную трубку. Проверка правильно выполненной интубации производится путем сравнительной аускультации дыхательных шумов над обоими легкими.
При назотрахеальной интубации трубку вводят через ноздрю (чаще правую - она у большинства людей шире) до уровня носоглотки и направляют в голосовую щель с помощью интубационных щипцов Мегилла под ларингоскопическим контролем.
В определенных ситуациях интубация трахеи может быть выполнена вслепую по пальцу или по леске, предварительно проведенной через перстневидно-щитовидную мембрану и голосовую щель.
Интубация трахеи полностью устраняет возможность обструкции верхних дыхательных путей, за исключением двух легко обнаруживаемых и устранимых осложнений: перегиба трубки и ее обтурации секретом из дыхательных путей.
Интубация трахеи не только обеспечивает свободную проходимость дыхательных путей, но и дает возможность вводить эндотрахеально некоторые медикаментозные препараты, необходимые при реанимации.
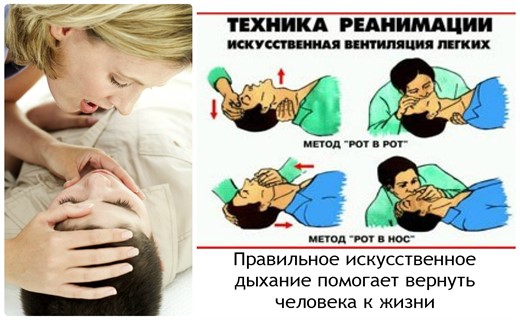
Искусственная вентиляция легких
Самыми простыми являются экспираторные способы ИВЛ ("рот в рот", "рот в нос"), которые используются в основном на догоспитальном этапе клинической смерти. Данные методы не требуют никакой аппаратуры, что является самым большим их преимуществом.
Наиболее часто применяется методика искусственного дыхания "рот в рот". Данный факт объясняется тем, что, во-первых, ротовую полость гораздо легче очистить от содержимого, чем носовые ходы, и, во вторых, меньшим сопротивлением, оказываемым вдуваемому воздуху. Техника выполнения ИВЛ "рот в рот" очень проста: реаниматор закрывает пациенту носовые ходы двумя пальцами или собственной щекой, вдыхает и, плотно прижимая свои губы ко рту реанимируемого, делает выдох в его легкие. После этого реаниматор несколько отстраняется, чтобы позволить воздуху выйти из легких больного. Частота искусственных дыхательных циклов зависит от возраста пациента. В идеале она должна приближаться к физиологической возрастной норме. Так, например, у новорожденных ИВЛ должна проводиться с частотой около 40 в минуту, а у детей 5-7 лет - 24-25 в минуту. Объем вдуваемого воздуха также зависит от возраста и физического развития ребенка. Критерием для определения должного объема служит достаточная амплитуда движения грудной клетки. Если грудная клетка не поднимается, то необходимо улучшить проходимость дыхательных путей.
Проведение искусственной вентиляции легких
Искусственное дыхание "рот в нос" применяется в тех ситуациях, когда в области рта имеются повреждения, не позволяющие создать условия максимальной герметичности. Техника данной методики отличается от предыдущей лишь тем, что вдувание воздуха производится в нос, а рот при этом плотно закрывается.
В последнее время для облегчения проведения всех трех вышеописанных способов искусственной вентиляции легких фирмой Аmbu Intenational выпускается простейшее приспособление, называемое "ключ жизни". Оно представляет собой вложенный в брелок от ключей полиэтиленовый листок, в центре которого находится плоский однонаправленный клапан, через который и производится вдувание воздуха. Боковые края листка зацепляются за ушные раковины больного с помощью тонких резинок. Неправильно применить этот "ключ жизни" очень трудно: на нем все нарисовано - губы, зубы, уши. Данное приспособление одноразовое и предохраняет от необходимости прикасаться непосредственно к пациенту, что иногда бывает небезопасно.
В том случае, когда для обеспечения свободной проходимости дыхательных путей использовались воздуховод или S-образная трубка. То можно осуществлять искусственное дыхание, используя их, как проводники вдуваемого воздуха.
На этапе врачебной помощи при проведении ИВЛ используется дыхательный мешок или автоматические респираторы.
Как проводится искусственная вентиляция легких детям?
Современные модификации дыхательного мешка имеют три обязательных составных части:
- пластиковый или резиновый мешок, расправляющийся (восстанавливающий свой объем) после сжатия за счет собственных эластических свойств или из-за наличия эластического каркаса;
- впускной клапан, обеспечивающий поступление воздуха из атмосферы в мешок (при расправлении) и к пациенту (при сжатии);
- безвозвратный клапан с адаптером для маски или интубационной эндотрахеальной трубки, который позволяет осуществляться пассивному выдоху в атмосферу.
В настоящее время большинство выпускаемых саморасправляющихся мешков оснащены штуцером для обогащения дыхательной смеси кислородом.
Основным преимуществом ИВЛ с помощью дыхательного мешка является то, что в легкие больного подается газовая смесь с содержанием кислорода от 21 %. Кроме того, искусственное дыхание, осуществляемое даже таким простым ручным респиратором, значительно экономит силы врача. Вентиляция легких дыхательным мешком может проводиться через лицевую маску, плотно прижатую к области рта и носа пациента, интубационную эндотрахеальную трубку или трахеостомическую канюлю.
Оптимальной является ИВЛ с помощью автоматических респираторов.
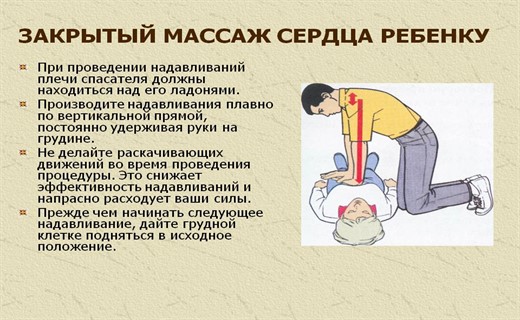
Закрытый массаж сердца
Помимо осуществления адекватной альвеолярной вентиляции основной задачей реанимации является поддержание хотя бы минимально допустимого кровообращения в органах и тканях, обеспечиваемого массажем сердца.
С самого начала применения закрытого массажа сердца считалось, что при его использовании главенствует принцип сердечной помпы, т.е. сдавление сердца между грудиной и позвоночником. На этом основаны определенные правила проведения закрытого кардиального массажа, которые действуют и до сих пор.
Проведение закрытого массажа сердца
При проведении реанимационных мероприятий пациент должен лежать на твердой поверхности (стол, скамейка, кушетка, пол). Причем, для обеспечения большего притока крови к сердцу во время искусственной диастолы, а также для предотвращения поступления крови в яремные вены во время сжатия грудной клетки (венозные клапаны в состоянии клинической смерти не работают) желательно, чтобы ноги пациента были приподняты на 60о над горизонтальным уровнем, а голова - на 20о.
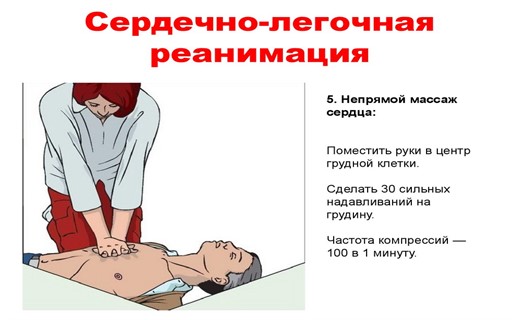
Для осуществления закрытого массажа сердца давление необходимо осуществлять на грудину. Точка приложения силы при компрессии у грудных детей располагается посередине грудины, а у более старших детей - между ее средней и нижней частью. У пациентов грудного возраста и новорожденных массаж производится кончиками ногтевых фаланг первого или второго и третьего пальцев, у детей от 1 до 8 лет - ладонью одной руки, старше 8 лет - двумя ладонями.
Вектор силы, прилагаемой при компрессии грудной клетки, должен быть направлен строго вертикально. Глубина смещения грудины и частота компрессий у детей разного возраста представлена в табл.
Таблица. Глубина смещения грудины и частота компрессий у детей разного возраста
| Возраст пациента | Глубина смещения грудины | Частота компрессий |
| До 1 года | 1,5-2,5 см | Не менее 100 в минуту |
| 1-8 лет | 2,5-3,5 см | 80-100 в минуту |
| Старше 8 лет | 4-5 см | Около 80 в минуту |
Как делать закрытый массаж сердца у детей?
Необходимо заметить, что рекомендуемая частота искусственных сердечных циклов больше, чем предлагавшаяся раньше. Однако, доказано, что увеличение числа компрессий в минуту обеспечивает повышение сердечного выброса.
Еще в недавнем прошлом при проведении реанимационных мероприятий классическим считалось соотношение искусственных вдохов и нажатий на грудную клетку 1:4 - 1:5. После того, как 70-80-х годах нашего столетия была предложена и обоснована концепция "грудного насоса" при закрытом массаже сердца, закономерно возник вопрос: так ли уж физиологически обоснована пауза для вдувания воздуха через каждые 4-5 компрессий грудины? Ведь поступление воздуха в легкие обеспечивает дополнительное интрапульмонарное давление, которое должно увеличить поступление крови из легких. Естественно, если реанимацию проводит один человек, а пациент не является новорожденным или грудным ребенком, то выбора у реаниматора нет - соотношение 1:4-5 будет соблюдаться. При условии же, что больным в состоянии клинической смерти занимаются два человека и больше, должны соблюдаться следующие правила:
Один оживляющий занимается искусственной вентиляцией легких, второй - массажем сердца. Причем, никаких пауз, никаких остановок ни в проведении первого, ни второго мероприятия быть не должно! В эксперименте было показано, что при одновременном сжатии грудной клетки и вентиляции легких с высоким давлением мозговой кровоток становится на 113-643 % больше, чем при стандартной методике.
Искусственная систола должна занимать не менее 50% от длительности всего сердечного цикла.
Утвердившееся представление о механизме грудной помпы, способствовало появлению некоторых оригинальных методик, позволяющих обеспечить искусственный кровоток при проведении реанимационных мероприятий.
На стадии эксперимента находится разработка "жилетной" сердечно-легочной реанимации, основанной на том, что грудной механизм искусственного кровотока может быть вызван периодическим раздуванием двустенного пневматического жилета, надетого на грудную клетку.
Вставленная абдоминальная компрессия
В 1992 году впервые у человека при клинической смерти был применен метод "вставленной абдоминальной компрессии" - ВАК, хотя данные научных разработок, которые легки в его основу были опубликованы еще в 1976 году. При проведении ВАК в реанимационных мероприятиях должны принимать участие как минимум три человека: первый осуществляет искусственную вентиляцию легких, второй сжимает грудную клетку, третий - тотчас после окончания сжатия грудной клетки сдавливает живот в области пупка по той же методике, что и второй реаниматор. Эффективность подобного метода при клинических испытаниях оказалась в 2-2,5 раза выше, чем при обычном закрытом массаже сердца. Вероятно, при ВАК имеется два механизма улучшения искусственного кровотока:
- Сжатие артериальных сосудов брюшной полости, включая аорту, создает эффект контрпульсации, увеличивая объем мозгового и миокардиального кровотока;
- Сжатие венозных емкостей брюшной полости повышает возврат крови к сердцу, что также способствует увеличению объема кровотока.
Естественно, что для предотвращения повреждения паренхиматозных органов при проведении реанимации с использованием "вставленной абдоминальной компрессии" требуется предварительная тренировка. Кстати, несмотря на кажущееся повышение риска регургитации и аспирации при ВАК, на практике все оказалось совершенно иначе - частота регургитации снизилась, потому что при компрессии живота сдавливается и желудок, а это препятствует его раздуванию при искусственном дыхании.
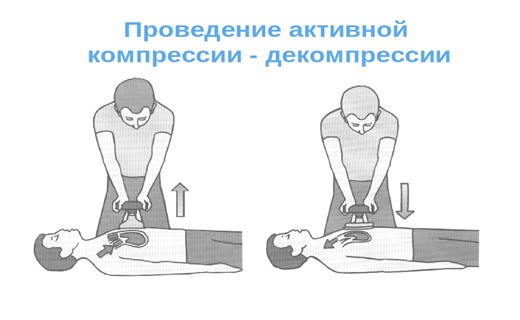
Методика активной компрессии-декомпрессии
Следующий метод активной компрессии - декомпрессии сейчас уже достаточно широко применяется во всем мире.
Суть методики состоит в том, что для СЛР применяется так называемый Cardio Pump (кардиопамп) - специальная круглая ручка с калибровочной шкалой (для дозировки усилий компрессии и декомпрессии), имеющая вакуумную присоску. Устройство, прикладывается к передней поверхности грудной клетки, присасывается к ней, и таким образом становится возможным осуществлять не только активное сжатие, но и активное растяжение грудной клетки, т.е. активно обеспечивать не только искусственную систолу, но и искусственную диастолу.
Эффективность этой методики подтверждается результатами многих исследований. Коронарное перфузионное давление (разница между аортальным и правопредсердным давлениями) увеличивается втрое, по сравнению со стандартной реанимацией, а именно оно является одним из важнейших прогностических критериев успеха СЛР.
Необходимость отметить тот факт, что последнее время активно изучается возможность искусственной вентиляции легких (одновременно с обеспечением кровообращения) с помощью методики активной компрессии-декомпрессии за счет изменения объема грудной клетки, а, следовательно, и дыхательных путей.
Открытый массаж сердца
В начале 90-х годов появилась информация о проведении успешного закрытого массажа сердца у больных в положении на животе, когда сжатие грудной клетки производилось со спины, а под грудину подкладывался кулак одного из реанимирующих. Определенное место в современных исследованиях занимает и кирасная СЛР, основанная на принципе высокочастотной механической вентиляции легких с помощью кирасного респиратора. Аппарат накладывается на грудную клетку и под воздействием мощного компрессора создаются чередуемые перепады давления - искусственных вдох и выдох.
Проведение открытого (или прямого) массажа сердца допускается только в госпитальных условиях. Техника его выполнения следующая: грудную клетку вскрывают в четвертом межреберье слева разрезом, от края грудины до средней подмышечной линии. При этом скальпелем рассекают кожу, подкожную клетчатку и фасцию грудных мышц. Далее корнцангом или зажимом перфорируют мышцы и плевру. Ранорасширителем широко раскрывают грудную полость и тотчас приступают к массажу сердца. У новорожденных и грудных детей удобнее всего прижимать сердце двумя пальцами к задней поверхности грудины. У детей старшего возраста сердце сжимают правой рукой так, чтобы первый палец располагался над правым желудочком, а остальные пальцы - над левым желудочком. Пальцы на миокард следует укладывать плашмя, чтобы не перфорировать его. Вскрытие перикарда обязательно только при нахождении в нем жидкости или для визуальной диагностики фибрилляций миокарда. Частота компрессий такая же, как и при закрытом массаже. Если внезапная остановка сердца произошла во время операции на органах брюшной полости, массаж можно проводить через диафрагму.
Экспериментально и клинически доказано, что прямой массаж сердца обеспечивает более высокое артериальное и более низкое венозное давление, результатом которых является лучшая перфузия сердца и мозга во время реанимационных мероприятий, а также большее количество выживших пациентов. Однако, эта манипуляция весьма травматична и может повлечь за собой множество осложнений.
Показаниями к открытому массажу сердца являются:
- Остановка сердца во время операций на грудной или брюшной полости;
- Наличие перикардиальной тампонады сердца;
- Напряженный пневмоторакс;
- Массивная тромбоэмболия легочной артерии;
- Множественные переломы ребер, грудины и позвоночника;
- Деформация грудины и/или грудного отдела позвоночника;
- Отсутствие признаков эффективности закрытого массажа сердца в течение 2,5-3 минут.
Необходимо отметить, что во многих зарубежных руководствах данный способ обеспечения кровотока при проведении реанимационных мероприятий у детей не поддерживается, а Американская Ассоциация Здоровья считает, что показанием к нему у педиатрических пациентов является только наличие проникающего ранения грудной клетки, да и то при условии, что состояние больного резко ухудшилось в больнице.
Итак, обеспечение свободной проходимости дыхательных путей, искусственная вентиляция легких и поддержание искусственного кровотока составляют этап первичной сердечно-сосудистой реанимации (или реанимации в объеме АВС).
Критериями эффективности мероприятий, проводимых при оживлении больного, являются:
- Наличие пульсовой волны на сонных артериях в такт компрессии грудины;
- Адекватная экскурсия грудной клетки и улучшение цвета кожных покровов;
- Сужение зрачков и появление реакции на свет.
Восстановление самостоятельного кровообращения
Второй раздел "азбуки Сафара" носит название "Восстановление самостоятельного кровообращения" и также состоит из трех пунктов:
- Drug (медикаменты).
- ECG (ЭКГ).
- Fibrillation (дефибрилляция)
Первое, что должен учитывать врач, проводящий реанимацию - медикаментозная терапия не заменяет ИВЛ и массаж сердца; она должна проводиться на их фоне.
Пути введения лекарственных препаратов в организм больного, находящегося в состоянии клинической смерти, требуют серьезного обсуждения.
До тех пор, пока не обеспечен доступ к сосудистому руслу, такие медикаменты, как адреналин, атропин, лидокаин могут быть введены эндотрахеально. Лучше всего подобную манипуляцию осуществлять через тонкий катетер, введенный в эндотрахеальную трубку. Лекарственное вещество в трахею можно ввести и через конио- или трахеостому. Всасывание препаратов из легких при наличии достаточного кровотока происходит почти так же быстро, как и при их внутривенном введении.
При осуществлении данной методики должны соблюдаться следующие правила:
- для лучшей всасываемости медикамент должен быть разведен в достаточном объеме воды или 0,9% раствора NaCl;
- дозу лекарственного вещества необходимо увеличить в 2-3 раза (правда, некоторые исследователи считают, что доза вводимого в трахею медикамента должна быть выше на целый порядок.);
- после введения препарата необходимо произвести 5 искусственных вдохов для его лучшего распространения по легким;
- сода, кальций и глюкоза вызывают серьезные, иногда необратимые повреждения легочной ткани.
Кстати, всеми специалистами, занимающимися изучением данной проблемы, отмечен тот факт, что при эндотрахеальном введении любой препарат действует дольше, чем при внутривенном.
Техника внутрисердечных инъекций
Показания к внутрисердечному введению медикаментов с помощью длинной иглы в настоящее существенно ограничены. Частый отказ от этого метода обусловлен достаточно серьезными причинами. Во-первых, игла, которой осуществляют пункцию миокарда, может повредить его настолько, что при последующем массажа сердца разовьется гемиперикард с тампонадой сердца. Во-вторых, игла может повредить легочную ткань (следствием чего станет пневмоторакс) и крупные коронарные артерии. Во всех этих случаях дальнейшие реанимационные мероприятия не принесут успеха.
Таким образом, вводить препараты внутрисердечно нужно только тогда, когда ребенок не интубирован и доступ к венозному руслу не обеспечен в течение 90 секунд. Пункцию левого желудочка производят длинной иглой (6-8 см) с присоединенным к ней шприцем, содержащим лекарственное средство. Укол делают перпендикулярно поверхности грудины у левого ее края в четвертом или пятом межреберье по верхнему краю нижележащего ребра. Проводя иглу вглубь, необходимо постоянно подтягивать поршень шприца на себя. При проколе стенок сердца ощущается небольшое сопротивление с последующим чувством "провала". Появление крови в шприце свидетельствует о нахождении иглы в полости желудочка.
Большинством зарубежных авторов рекомендуется внутрисердечное введение медикаментов только при проведении открытого массажа сердца при визуальном коньроле и с помощью обычной инъекционной, тонкой иглы.
Техника внутривенной инъекции
Внутривенный путь введения лекарственных препаратов является наиболее предпочтительным при проведении СЛР. При возможности желательно использовать центральные веры. Это правило особенно актуально при проведении реанимации у детей, так как пункция периферических вен у данного контингента больных может быть достаточно затруднена. Кроме того, у пациентов в состоянии клинической смерти кровоток на периферии, если и не отсутствует полностью, то крайне мал. Этот факт дает основания сомневаться в том, что вводимый препарат быстро достигнет точки приложения своего действия (нужного рецептора). Еще раз подчеркиваем, что, по мнению большинства специалистов, во время реанимации на попытку пункции периферической вены у ребенка нельзя тратить больше 90 секунд - после этого следует перейти к иному пути введения препаратов.
Техника внутрикостной инъекции
Внутрикостный путь введения лекарственных средств при реанимации является одним из альтернативных доступов к сосудистому руслу или критических состояниях. Данный метод не получил широкого распространения в нашей стране, однако известно, что при определенном оснащении и наличии у реанимирующего необходимых практических навыков внутрикостный способ значительно сокращает время, необходимое для доставки медикамента в организм больного. По венозным каналам из кости имеется прекрасный отток, и препарат, введенный в кость, быстро оказывается в системном кровотоке. Необходимо отметить, что вены, находящиеся в костном мозге, не спадаются. Для введения лекарственных веществ наиболее часто используются пяточная кость и передневерхняя ость подвздошной кости.
Все медикаментозные средства, применяемые при проведении реанимации, подразделяются (в зависимости от срочности их введения) на препараты 1-й и 2-й группы.
Препараты используемые в реанимации
Адреналин уже в течение долгих лет удерживает первенство среди всех лекарственных средств, используемых при реанимационных мероприятиях. Его универсальный адреномиметический эффект способствует стимуляции всех функций миокарда, повышению диастолического давления в аорте (от которого зависит коронарный кровоток), расширению мозгового микроциркуляторного русла. По данным экспериментальных и клинических исследований ни один синтетический адреномиметик не имеет преимуществ перед адреналином. Доза данного препарата - 10-20 мкг/кг (0,01-0,02 мг/кг) Повторно препарат вводится через каждые 3 минуты. При отсутствии эффекта после двукратного введения, доза адреналина увеличивается в 10 раз (0,1 мг/кг). В дальнейшем эта же дозировка повторяется через 3-5 минут.
Атропин, будучи м-холинолитиком, способен устранять тормозящее влияние ацетилхолина на синусовый и атриовентрикулярный узел. Кроме того, возможно, он способствует высвобождению катехоламинов из мозгового слоя надпочечников. Препарат применяется на фоне проводимых реанимационных мероприятий при наличии единичных сердечных сокращений в дозе 0,02 мг/кг. Следует иметь в виду, что меньшие дозировки могут вызвать парадоксальный парасимпатомиметический эффект в виде усиления брадикардии. Повторное введение атропина допустимо через 3-5 минут. Однако, его суммарная доза не должна превышать 1 мг у детей до 3 лет и 2 мг у более старших пациентов, так как это чревато отрицательным влиянием на ишемизированный миокард.
Всякая остановка кровообращения и дыхания сопровождается метаболическим и дыхательным ацидозом. Сдвиг pH в кислую сторону, нарушает работу ферментных систем, возбудимость и сократимость миокарда. Именно поэтому использование такого сильного антиацидотического средства, как гидрокарбонат натрия считалось обязательным при проведении СЛР. Однако исследования ученых выявили ряд опасностей, связанных с применением данного препарата:
- рост внутриклеточного ацидоза из-за образования СО2 и, как следствие этого, снижение возбудимости и сократимости миокарда, развитие гипернатриемии и гиперосмолярности с последующим уменьшением коронарного перфузионного давления;
- смещение кривой диссоциации оксигемоглобина влево, из-за чего нарушается оксигенация тканей;
- инактивация катехоламинов;
- снижение эффективности дефибрилляции.
В настоящее время показаниями к введению гидрокарбоната натрия являются:
- Остановка сердца на фоне тяжелого метаболического ацидоза и гиперкалиемии;
- Затянувшаяся сердечно-легочная реанимации (более 15-20 минут);
- Состояние после восстановления вентиляции и кровотока, сопровождающееся документально подтвержденным ацидозом.
- Доза препарата - 1 ммоль/кг массы тела (1 мл 8,4% раствора /кг или 2 мл 4% раствора / кг).
В начале 90-х годов было установлено, что нет доказательств положительного влияния препаратов кальция на эффективность и исходы сердечно-легочной реанимации. Наоборот, повышенный уровень ионов кальция способствует усилению неврологических расстройств после ишемии мозга, так как способствует усилению его реперфузионных повреждения. Кроме того, кальций вызывает нарушение продукции энергии и стимулирует образование эйкосаноидов. Поэтому показаниями к применению препаратов кальция при проведении реанимации являются:
- Гиперкалиемия;
- Гипокальциемия;
- Остановка сердца на фоне передозировки антагонистов кальция;
- Доза CaCl2 - 20 мг/кг, кальция глюконата - в 3 раза больше.
При фибрилляции сердца в комплекс медикаментозной терапии включается лидокаин, которые считается одним из лучших средств для купирования данного состояния. Его можно вводить как до, так и после проведения электрической дефибрилляции. Доза лидокаина у детей - 1 мг/кг (у новорожденных - 0,5 мг/кг). В дальнейшем возможно применение поддерживающей инфузии со скоростью 20-50 мкг/кг/мин.
К медикаментозным средствам второй группы относятся допамин (1-5 мкг/кг/мин при уменьшенном диурезе и 5-20 мкг/кг/мин - при сниженной сократимости миокарда), глюкокортикоидные гормоны, кокарбоксилаза, АТФ, витамины С, Е и группы В, глютаминовая кислота, инфузии глюкозы с инсулином.
Для обеспечения выживаемости пациентов должна быть применена инфузия изотонических коллоидов или кристаллоидов, не содержащих глюкозу.
По данным некоторых исследователей хороший эффект при проведении реанимационных мероприятий могут оказать следующие препараты:
- орнид в дозе 5 мг/кг, повторная доза через 3-5 минут 10 мг/кг (при стойкой фибрилляции желудочков или тахикардии);
- изадрин в виде инфузии со скоростью 0,1 мкг/кг/мин (при синусовой брадикардии или атриовентрикулярной блокаде);
- норадреналин в виде инфузии со стартовой скоростью 0,1 мкг/кг/мин (при электромеханической диссоциации или слабой сократимости миокарда).
Е - электрокардиография считается классическим методом мониторинга сердечной деятельности при проведении реанимационных мероприятий. При различных обстоятельствах на экране или ленте электрокардиографа могут наблюдаться изолиния (полная асистолия), единичные сердечные комплексы (брадикардия), синусоида с меньшей или большей амплитудой колебаний (мелко- и крупноволновая фибрилляция). В отдельных случаях прибором может регистрироваться практически нормальная электрическая активность сердца, при отсутствии сердечного выброса. Такая ситуация может возникнуть при тампонаде сердца, напряженном превмотораксе, массивной тромбоэмболии легочной артерии, кардиогенном шоке и других вариантах резко выраженной гиповолемии. Данный вид остановки сердца называется электромеханической диссоциаций (ЭМД). Необходимо отметить, что по данным некоторых специалистов ЭМД встречается при сердечно-легочной реанимации более, чем у половины больных (правда, эти статистические исследования проводились среди пациентов всех возрастных групп).

Дефибрилляция сердца
Естественно, что данный реанимационный прием используется только при подозрении на фибрилляцию сердца или при ее наличии (что можно установить со 100%-й уверенностью только с помощью ЭКГ).
Существует четыре вида дефибрилляции сердца:
- химическая,
- механическая,
- медикаментозная,
- электрическая.
Проведение дефибрилляции сердца
- Химическая дефибрилляция заключается в быстром внутривенном введении раствора КСl. Фибрилляция миокарда после данной процедуры прекращается и переходит в асистолию. Однако, восстановить после этого сердечную деятельность удается далеко не всегда, поэтому этот метод дефибрилляции в настоящее время не используется.
- Механическая дефибрилляция хорошо известна под названием прекардиальный или "реанимационный" удар и представляет собой удар кулаком (у новорожденных - щелчок) по грудине. Пусть редко, но она может оказаться эффективной и, в то же время, не приносящей пациенту (учитывая его состояние) какого-либо ощутимого вреда.
- Медикаментозная дефибрилляция заключается во введении антиаритмических препаратов - лидокаина, орнида, верапамила в соответствующих дозировках.
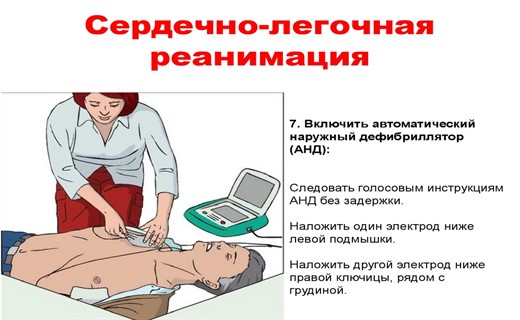
- Электрическая дефибрилляция сердца (ЭДС) - самый эффективный метод и важнейший компонент сердечно-легочной реанимации. ЭДС должна проводиться как можно раньше. От этого зависит и скорость восстановления сердечных сокращений, и вероятность благоприятного исхода СЛР. Дело в том, что во время фибрилляций быстро истощаются энергетические ресурсы миокарда, и чем дольше длится фибрилляция, тем менее вероятным становится последующее восстановление электрической стабильности и нормальной работы сердечной мышцы.
Методика дефибрилляции сердца
При проведении ЭДС необходимо строго соблюдать определенные правила:
Все разряды должны осуществляться во время выдоха, чтобы размеры грудной клетки были минимальны - это снижает трансторакальное сопротивление на 15-20%.
Необходимо, чтобы интервал между разрядами был минимальным. Каждый предыдущий разряд снижает трансторакальное сопротивление на 8% и при последующем разряде миокард получает большую энергию тока.
Во время каждого из разрядов все участвующие в реанимационных мероприятиях, за исключением человека, проводящего ЭДС, должны отойти от больного (на очень короткий промежуток времени - меньше секунды). Перед разрядом и после него мероприятия по поддержанию искусственной вентиляции, кровотока, медикаментозная терапия продолжаются в той мере, в какой они необходимы пациенту.
Металлические пластины электродов дефибриллятора необходимо смазывать электродным гелем (кремом) или использовать прокладки, смоченные раствором электролита.
В зависимости от конструкции электродов, может быть два варианта их расположения на грудной клетке:
- первый электрод устанавливается в область второго межреберья справа от грудины (+), второй - в область верхушки сердца (-).
- "плюсовой" электрод располагается под правой нижнелопаточной областью, а отрицательно заряженный - по левому краю нижней половины грудины.
Не следует проводить электрическую дефибрилляцию на фоне асистолии. Ничего, кроме повреждения сердца и других тканей, это не принесет.
В зависимости от типа дефибриллятора величина разряда измеряется либо в вольтах (В), либо в джоулях (Дж). Таким образом, необходимо знать два варианта "дозирования" разрядов.
Итак, в первом случае это выглядит следующим образом (табл.):
Таблица. Величины разряда (вольты) при дефибрилляции у детей
| Возраст | Первый разряд | Увеличение каждого последующего разряда по отношению к предыдущему | Максимальный разряд |
| 1-3 года | 1000 В (1 кВ) | +100 В | 2000 В (2 кВ) |
| 4-8 лет | 2000 В (2 кВ) | +200 В | 4000 В (4 кв) |
| Старше 8 лет | 3500-4000 В (3,5-4 кВ) | +500 В | 6000 В (6 кВ) |
Если же шкала величин разрядов градуирована в джоулях, то подбор необходимой "дозы" электрического тока осуществляется в соответствии со значениями, указанными в таблице ниже.
Таблица. Величины разряда (джоули) при дефибрилляции у детей
| Возраст | Первый разряд | Увеличение каждого последующего разряда по отношению к предыдущему | Максимальный разряд |
| До 14 лет | 2 Дж/кг | + 0,5 Дж/кг | 5 Дж/кг |
| Старше 14 лет | 3 Дж/кг | + 0,5 Дж/кг | 5 Дж/кг |
Техника дефибрилляции сердца
При проведении электрической дефибрилляции на открытом сердце величина разряда уменьшается в 7 раз.
Необходимо отметить тот факт, что в большинстве современных зарубежных руководств по сердечно-легочной реанимации у детей рекомендуется проводить ЭДС сериями из трех разрядов (2Дж/кг - 4 Дж/кг - 4 Дж/кг). Причем, если первая серия оказывается неуспешной, то на фоне продолжающегося массажа сердца, ИВЛ, медикаментозной терапии и метаболической коррекции должна быть начата вторая серия разрядов - опять с 2 Дж/кг.
После успешной реанимации больные должны быть переведены в специализированное отделение для дальнейшего наблюдения и лечения.
Очень важными для врачей всех специальностей являются проблемы, связанные с отказом от проведения сердечно-легочной реанимации и с ее прекращением.
СЛР можно не начинать, когда в условиях нормотермии:
- остановка сердца произошла на фоне полного комплекса интенсивной терапии;
- больной находится в терминальной стадии неизлечимой болезни;
- с момента остановки сердца прошло больше 25 минут;
- при документированном отказе больного от сердечно-легочной реанимации (если пациентом является ребенок в возрасте до 14 лет, то документированный отказ от проведения реанимационных мероприятий должны подписывать его родители).
СЛР прекращают, если:
- по ходу реанимации выяснилось, что она больному не показана;
- при использовании всех доступных методов СЛР не отмечено признаков эффективности в течение 30 минут;
- наблюдаются многократные остановки сердца, не поддающиеся никаким медицинским воздействиям.

