Дыхательные пути выстланы изнутри слоем секрета, образованного бокаловидными клетками, подслизистыми железами. Он - важнейший и защитный барьер и защитный механизм эпителия. Барьер - как слой и механизм - как способ очистки. Секрет не однородный, он устроен сложно.
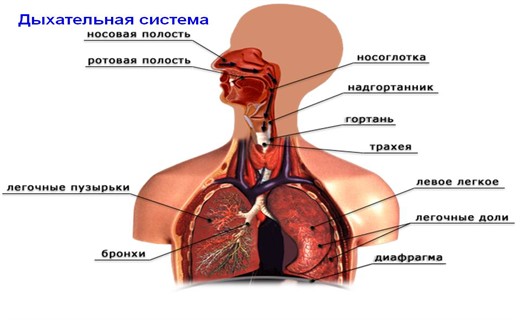
Как устроены дыхательные пути человека?
Секрет разделяется на два слоя.
Жидкий водный слой (золь)
Пристеночно расположен жидкий водный слой (золь). Собственно секрет - верхний слой (гель), более плотный, вязкий. Золь состоит из секрета желёз, капиллярного транссудата, межтканевой жидкости и представляет собой раствор различных химических соединений. Эта жидкость имеет вязкость, сходную с вязкостью плазмы. Толщина слоя золя (водной гипофазы секрета) стабильна, т.к. она обеспечивает свободные колебательные движения ресничек. В составе геля, собственно секрета, основное значение принадлежит гликопротеинам, которые секретируются бокаловидными клетками. Кроме того, в состав геля входят трансферрин, лизоцим, альбумин и другие соединения, выделяемые бокаловидными клетками и поступающие в результате транссудации из капилляров (иммуноглобулин А, сурфактант, комплекс липидов), играющие важную роль в адгезии секрета и сказывающиеся на структуре слизи. Все элементы связаны дисульфидными, ионными и другими связями.
Гелевый секреторный слой
Гелевый секреторный слой дыхательных путей легких находится на ковре из ресничек, погружённых в жидкую гипофазу (золь). Реснички мерцательного эпителия внедряются в водную гипофазу и своими колебательными движениями переносят расположенный на гипофазе слизистый слой в сторону глотки. Деление на водную гипофазу (золь) и слизистый слой (гель) имеет большое физиологическое значение. Незначительная вязкость гипофазы облегчает биение ресничек эпителия, а высокая вязкость слизистого слоя обуславливает захват и транспорт инородных частиц. Т.е. для мукоцилиарного клиренса необходимы хорошая работа ресничек и соответствующие реологические параметры секрета, прежде всего - вязкость и эластичность. Изменение двух последних величин тут же сказывается на мукоцилиарном транспорте: вязкий секрет невозможно продвинуть, жидкий - "работа вхолостую".
Вязкость и эластичность секрета
Вязкость и эластичность секрета зависят от количества воды и входящих в его состав гликопротеинов - муцинов. Муцины секрета принадлежат к двум различным подтипам: кислые муцины (сиало- и сульфомуцины) и нейтральные (фукомуцины). Сиаломуцины гидрофильны и составляют 55% всех гликопротеинов. Фукомуцины гидрофобны и составляют 40% всех гликопротеинов. Оставшиеся 5% приходятся на нейтральные гликопротеины - сульфомуцины.
При различных патологических состояниях с нарушением секреции соотношение этих гликопротеинов меняется, но определяющим является концентрация сиало- и фукомуцинов. Снижение уровня сиаломуцинов сопровождается уменьшением водного компонента секрета, что характерно для большинства заболеваний органов дыхания, протекающих с нарушением секреции. Вместе со снижением уровня сиаломуцинов увеличивается количество фукомуцинов, отталкивающих воду. Всё это приводит к тому, что секрет становится вязким и густым. При общем снижении количества муцинов вязкость уменьшается.
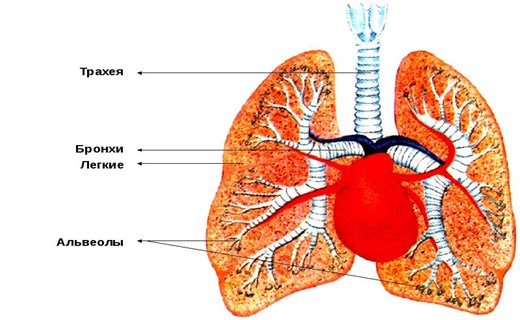
Строение трахеи и бронхов
Трахея и два главных бронха связывают гортань с лёгкими. Передняя и боковые стенки трахеи и бронхов образованы подковообразными хрящами, соединёнными фиброэластической мембраной. Густая сеть коллагеновых и эластических волокон, образующих фиброэластическую мембрану, вертикально натянутую между хрящевыми полукольцами, обуславливает возможность изменения длины трахеи и бронхов.
Благодаря мембране трахея и бронхи способные увеличиваться в длину на 50% своего первоначального размера. Задняя стенка построена из соединительной ткани и мышечной пластинки. Последняя образована гладкой мышцей М. trachealis, волокна которой лежат в поперечном направлении. Подковообразные хрящи трахеи и бронхов стремятся развернуться, а трахеальная мышца играет роль тетивы, удерживающей их и регулирующей диаметр трахеи и главных бронхов. При спокойном дыхании мышца напряжена. При форсированном дыхании тонус мышцы снижается, и диаметр трахеи увеличивается.
Слизистая оболочка трахеи и бронхов плотно прилежит к их передней и боковым стенкам. На задней стенке она подвижна и при сокращении М. trachealis собирается в вертикальные складки. Диаметр проводящих дыхательных путей и их длина при прочих равных условиях (вязкость газа, природа воздушного потока) определяют сопротивление потоку воздуха.
Во время спокойного дыхания воздушный поток, особенно в малых дыхательных путях, ламинарный. В таких случаях сопротивление пропорционально 4-х кратному радиусу просвета бронха. При высокой скорости потока он становится турбулентным, и сопротивление нарастает. Как видно из соотношения диаметра бронха и сопротивления потоку воздуха, даже небольшое изменение просвета бронха существенно повышает сопротивление дыханию. Этот феномен особенно выражен у новорождённых.
Трахея и бронхи: анатомия
Респираторный эпителий трахеи состоит из многослойного призматического эпителия и представлен в основном базальными клетками, мерцательным эпителием и бокаловидными клетками. Наряду с этим имеется большое число эндокринных и нейроэндокринных клеток. Базальные клетки лежат на базальной мембране, но не достигают поверхности эпителиального слоя. В терминальных бронхиолах между реснитчатыми клетками вкраплены прозрачные клетки.
Они характеризуются высокой метаболической и секреторной активностью, играют роль стволовых клеток. С 16 недели гестации обнаруживаются внутри-эпителиальные лимфоциты. У взрослых в эпителии находятся и мастоциты, но у плодов их нет.
Все клетки лёгочного эпителия развиваются путём дифференциации и созревания примитивных энтодермальных клеток. Процесс протекает центрифугально: от крупных дыхательных путей к периферическим. Прозрачные клетки (безреснитчатые бронхиолярные клетки) развиваются во второй половине внутриутробного периода из примитивных безреснитчатых гликогенсодержащих клеток терминальных дыхательных путей. Созревание заключается в постепенной потере гранул гликогена, накоплении рибосом и появлении электронно-плотных секреторных гранул. В гранулах содержится большое количество антипротеаз.
В проксимальных и дистальных воздухоносных путях по мере созревания лёгкого от фетального периода к постнатальному толщина клеточного уменьшается и нарастает относительный размер просвета бронха.
Заболевания дыхательных путей и ЛОР-органов у детей
Патофизиологические, реологические и клинические проявления большинства заболеваний дыхательных путей и ЛОР-органов свидетельствуют о важности секреторных нарушений как патогенетического звена. Так, воспаление сопровождается гипертрофией, гиперплазией, гиперфункцией бокаловидных железистых клеток с усилением секреции слизи, уменьшением сиаломуцинов, значительным увеличением количества фукомуцинов, что приводит к повышению вязкости слизи. Последнее ведёт к застою, что, соответственно, способствует размножению бактерий. В этих условиях реснитчатый эпителий работает с усиленной нагрузкой, но не в состоянии обеспечить должный транспорт слизи.
Длительная перегрузка приводит к истощению мукоцилиарного аппарата, дистрофии и атрофии эпителия. Хроническое воспаление, заболевания с интерстициальным компонентом, аутоиммунными реакциями сопровождаются уменьшением секреции слизи, уменьшением толщины водной гипофазы. При различных патологических состояниях вязкость и эластичность секрета меняются различным образом, и различные комбинации реологических параметров могут давать много разновидностей секрета, что требует осмысленного подбора муколитиков.
В собственной пластинке (Lamina propria) дыхательных путей легких и частично между хрящевыми полукольцами располагаются многочисленные слизистые железы, где они могут простираться вплоть до адвентиции. У взрослых слизистые железы занимают до 12% площади стенки бронха, у детей - 17%. Т.е. гипертрофия слизистых желёз способна вызвать у детей значительно больше изменений, чем у взрослых (W. Field, 1968, К. Matsuba e.a., 1972). Железы закладываются в трахее на 10 неделе гестации. По мере развития лёгкого они концентрируются в области бифуркации бронхов и по переднебоковым стенкам.
Состав, функции и свойства слизи легких
Лизоцим синтезируется альвеолярными макрофагами и эпителиальными клетками. Лизирует лизоцимчувствительные бактерии путём гидролиза связи 1-4 между N-ацетилмураминовой кислоты и N-ацетилглюкозамина в мукопо-лисахаридах бактериальной стенки. Лизирующая способность энзима усиливается секреторным IgA. Бактерии, нечувствительные к лизоциму, например, Enterobactenaceae, подвергаются предварительно действию перекиси водорода, образуемой альвеолярными макрофагами.
Лактоферрин - железосвязывающий протеин, образуемый альвеолярными макрофагами, нейтрофильными гранулоцитами и эпителиальными клетками, достаточно устойчив к действию бактериальных протеаз. 1 моль лактоферрина в присутствии бикарбоната связывает 2 моля ионов железа. Возникающий дефицит железа затрудняет деление бактерий.
Фибронектин образуется альвеолярными макрофагами и фибробластами, действует как неспецифический опсонин. Стимулирует рост мезенхимы лёгкого, поддерживая тем самым структурное единство лёгкого.
Дефензины, мелкие катионные цитотоксические пептиды, построены из 29-35 аминокислотных остатков, синтезируются преимущественно эпителием и нейтрофилами, токсичны для большого числа грамположительных и грамотрицательных возбудителей, грибков и вирусов. Дефензины внедряются в стенку микроорганизмов и резко повышают её проницаемость. Ранее у человека был известен только дефензин-а, синтезируемый нейтрофильными гранулоцитами и накапливаемый в их азурофильных гранулах. В здоровых лёгких нейтрофилов очень мало, поэтому дефензин-а в норме особого значения не имеет. Но недавно в эпителиальных клетках человеческого лёгкого и в альвеолярных макрофагах обнаружен дефензин-В, который ранее был известен только у животных как "трахеальный антимикробный пептид". Дефензин-В отличается от дефензина-а своей третичной структурой, он не накапливается в гранулах. Синтез дефензина-В усиливается под действием провоспалительных цитокинов. Примечательно, что концентрация дефензина-В зависит от концентрации хлористого натрия. При высокой концентрации хлористого натрия, как это происходит при муковисцидозе, активность дефензин-В по отношению Ps. aeruginosa резко падает.
Сурфактант обычно рассматривается как вещество, обеспечивающее биофи-зикальные характеристики лёгкого, направленные против его спадания. Однако сурфактантпротеин A (SP-A) и сурфактантпротеин-D (SP-D) способны связывать бактерии, грибы и вирусы. Очень важно, что сурфактант способен связывать бескапсульные формы Hem. influenzae, которые ответственны за большое число случаев респираторных инфекций. Примечательно, что вакцина от Hem. influenzae b не защищает от указанных инфекций. SP-A усиливает антимикробную функцию альвеолярных макрофагов.
Роль С-волокон в легких ребенка
Легочные механорецепторы
Третьей группой легочных механорецепторов являются С-волокна - тонкие немиелинизированные волокна, представляющие собой медленно проводящие вагусные афференты. С-волокна оканчиваются в паренхиме легких, бронхиального дерева и кровеносных сосудах. Следовательно, они доступны для медиаторов, присутствующих в крови капилляров или бронхиальных артерий.
Роль С-волокон в легких ребенка
Активность С-волокон не зависит от фазы дыхания, им принадлежит небольшая роль при регуляции нормальных вдоха и выдоха. Эти волокна стимулируются при воздействии раздражающих веществ, эндогенных медиаторов (например, брадикинина), а также при механическом раздражении дыхательных путей. Активация С-волокон приводит к частому поверхностному дыханию, которое ограничивает рассеивание потенциально опасных агентов по трахеобронхиальному дереву. С-волокна могут играть важную роль в передаче ощущения диспноэ в различных клинических ситуациях, таких как отек легких, пневмония или вдыхание токсических веществ. Их стимуляция вызывает брадикардию и увеличение секреции слизи в просвет бронхов.
Активация J-рецепторов С-волокнами
Также С-волокна стимулируются при развитии интерстициального отека легких за счет активации J-рецепторов, находящихся в паренхиме легких, прилегающей к капиллярам. Активация J-рецепторов вызывает закрытие гортани и апноэ, за которым следует частое поверхностное дыхание. Этот процесс также может иметь важное значение в передаче ощущения диспноэ при отеке легких, пневмонии и легочной эмболии.
Мастоциты - важнейший источник интерлейкинов IL-4, IL-5, IL-б, IL-8, IL-13, TNF-ce, GM-CSF. m-PHK этих цитокинов индуцируется IgE-зависимым механизмом.
Все выше перечисленные соединения, освобождаемые мастоцитами, ведут, наряду с рекрутированием других клеток, к мобилизации ключевых клеток иммунитета: Т-клеток.
Т-клетки в естественной защите легких
Т-клетки - главные клетки процесса воспаления, в том числе и иммунного. Т-клетки обнаружены и в бронхоальвеолярной жидкости, и в биоптатах. В зависимости от синтезируемых цитокинов выделяют 2 типа Т-хелперов (ТЫ и Th2). Оба подтипа клеток секретируют IL-13 и GM-CSF. Thl синтезирует IL-2, IFN-y и TNF-cc. IL-2 стимулирует Т-клеточную пролиферацию. IFN-y ингибирует активацию В-клеток и синтез IgE. Эти цитокины важны для развёртывания реакции гиперчувствительности отсроченного типа при хронических гранулёматозах (туберкулёз, саркоидоз, проказа). Th2 синтезируют IL-4, IL-5, IL-9 и IL-13, но не способны образовывать IFN-r или IL-2. IL-4 и IL-13 требуются для переключения В-клеток на синтез IgE и усиления экспрессии VCAM-1 на клетках эндотелия. IL-13, IL-5 и GM-CSF обеспечивают созревание, выживание и хемотаксис эозинофилов, синтез LT-C4. Даже вне приступа в дыхательных путях содержится большое количество ТИ2-клеток и клеток, экспрессирующих m-PHK цитокинов IL-3, IL-4, IL-5, IL-13 и GM-CSF, но не IFN-y. После контакта с аллергеном ещё больше возрастает популяция субтипов Т-клеток, экспрессирующих IL-4, IL-5 и IL-13. Одновременно на 60% снижается экспрессия IFN-y и на 37% - IL-2.
Активация Т-клеток
В активации Т-клеток задействованы молекулы-ко-стимуляторы. Антиген-презентирующие клетки принимают на себя ингалированный антиген и с помощью молекул II класса главного комплекса гистосовместимости (МНС) передают его на С04-клетки. Взаимодействие молекул II класса МНС с Т-клетками происходит за счёт взаимодействия CD28 на Т-клетках и В7-1 (CD80) и В7-2 (CD86) на В-клетках. На поверхности Т-клеток расположена и молекула CTLA-4, тесно взаимодействующая с CD28. Так как активация CD28 приводит к транскрипции Тп2 цитокинов, активация CTLA-4 этот процесс эффективно блокирует. Культивируемые бронхиальные биоптаты после стимуляции аллергеном усиленно выделяют IL-4, IL-5 и IL-13, но не IFN-y. Этот процесс резко замедляется при коинкубации с анти-С028 или анти-С08б. Более того, аллерген-индуцированный синтез IL-5 и IL-13 ингибируется добавлением CTLA-4 Ig, что отражает важность пути CD80/86-CD28 для синтеза Тп2-цитокинов. Результаты обсуждаемых нами исследований свидетельствуют, что Т-клеточный ответ при БА сдвигается в сторону Тп2. Можно предположить, что перспективным направлением лечения БА могла бы быть блокада Тп2-цитокинов или перевод иммунного ответа наТИ1.
NK-клетки
NK-клетки (естественные киллеры) - лимфоциты, которые не имеют Т-клеточного рецептора. В периферической крови численность NK-клеток достигает 10% от всех лимфоцитов, в здоровом лёгком не более 2% лимфоцитов соответствуют фенотипу NK (CD3~, СПб*, NKH1+). NK способны оказывать независимую от антител и МНС цитотоксичность по отношению к вирус-инфицированным клеткам. IL-2, выделяемый активированными С04+-клетками (Т-хелперами), в свою очередь, активирует NK, которые начинают выделять IFN-y, GM-CSF, TNF и хемокины, сопрягая тем самым неспецифический и специфический иммунные ответы.

